In часть первая этой статьиЯ рассмотрел договорную и нормативную базу, применяемую правительством США к первоначальной разработке, производству и приобретению инъекций мРНК Covid, используя соглашения BioNTech/Pfizer для иллюстрации этого процесса.
Я показал, что этим продуктам было выдано разрешение на экстренное использование (EUA) на основании клинических испытаний и производственных процессов, проведенных с использованием
- отсутствие обязательных правовых стандартов,
- отсутствие законодательно запрещенного надзора или регулирования безопасности, и
- никакого юридического возмещения со стороны производителя за потенциальный вред.
В этой последующей статье я предоставлю подробный анализ базовой документации.
Другое разрешение на сделку/соглашение (OTA): путь военных закупок
Ассоциация соглашение Между правительством США, представленным Министерством обороны (DoD), и Pfizer, представляющим партнерство BioNTech/Pfizer, в июле 2020 года закупка «вакцины для предотвращения COVID-19» не была обычным контрактом на приобретение.
Это было соглашение в рамках Other Transaction Authority (OTA) – путь приобретения, который, согласно Рекомендации Министерства обороны, используется с 1958 года, чтобы «разрешить федеральному агентству вступить в операции, кроме контрактов, грантов или соглашений о сотрудничестве".
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
Тщательный обзор использования OTA Министерством обороны, включая его законодательную историю, можно найти в 22 февраля 2019 г. Отчет Исследовательской службы Конгресса США. В этом отчете, как и во всех других обсуждениях OTA, указывается, что это альтернативный путь приобретения. для оборонных и военных целей. Он не предназначен и никогда не использовался до Covid для чего-либо, предназначенного в первую очередь для гражданского использования.
Если вы ищете Законы OTA в Кодексе США, это путь, по которому вы пойдете:
Вооруженные силы -> Общее военное право -> Приобретение -> Исследования и разработки -> Соглашения -> Полномочия Министерства обороны на реализацию определенных проектов прототипов.
Этот юридический путь очень ясно показывает, что законы ОТА предназначены для приобретения исследовательских и инженерных прототипов для вооруженных сил.
Министерство обороны имеет полномочия на три различных типа ОТ: (1) исследовательские ОТ, (2) прототипные ОТ и (3) производственные ОТ.
Эти три типа ОТ представляют собой три этапа первоначальных исследований, разработки прототипа и конечного производства.
В рамках этих трех типов существуют определенные категории проектов, к которым может применяться OTA:
- Первоначально, согласно Обзор ОТА Согласно предоставленному Министерством обороны, Управление по другим сделкам было «ограничено применимо к оружию или системам вооружения, которые предлагалось приобрести или разработать Министерством обороны».
- Позже OTA был расширен и теперь включает в себя «любой прототипный проект, непосредственно связанный с повышением эффективности миссии военного персонала и вспомогательных платформ, систем, компонентов или материалов, которые предлагается приобрести или разработать Министерству обороны, или с усовершенствованием платформ, систем, компонентов». или материалы, используемые Вооруженными Силами».
Пока что ничто из этого не похоже на путь приобретения миллионов новых медицинских продуктов, предназначенных в первую очередь для гражданского использования.
Существует ли какое-либо исключение для использования ОТА в гражданских целях, которое может применяться к мРНК-вакцинам Covid?
Ассоциация Закон о полномочиях национальной обороны на 2004 финансовый год (PL 108–136) содержал раздел, в котором полномочия по другим транзакциям назначались «главе исполнительного агентства, которое занимается фундаментальными исследованиями, прикладными исследованиями, перспективными исследованиями и разработками», которые «имеют потенциал для облегчения защиты от терроризма или ядерного, биологического, ядерного или восстановления после него». химическое или радиологическое нападение».
Действие этого положения было продлено до 2018 года, но, похоже, не продлевалось и после этого года. Также обратите внимание, что даже в этом исключительном случае использования OTA не министерством обороны, ситуация должна включать терроризм или атаку с применением оружия массового уничтожения (ХБРЯ).
Какие еще законы OTA могут применяться?
В цитированном выше отчете CRS за 2019 год представлена эта диаграмма, показывающая, что несколько агентств, не входящих в Министерство обороны, имеют некоторые OTA или соответствующие полномочия:
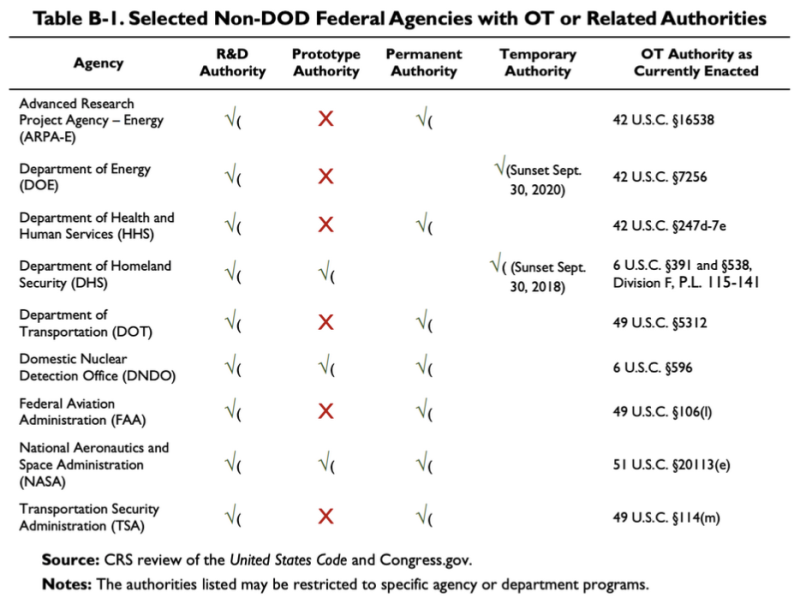
Согласно этой таблице, Министерство здравоохранения и социальных служб (HHS) имеет некоторые другие органы по исследованиям и разработкам (НИОКР). Закон, касающийся Полномочия OT HHS составляют 42 U.S.C. §247d-7e.
Где находится этот закон и что в нем говорится?
Общественное здравоохранение и благосостояние -> Служба общественного здравоохранения -> Общие полномочия и обязанности -> Сотрудничество федеральных штатов -> Управление перспективных биомедицинских исследований и разработок (BARDA) -> Органы по транзакциям
Таким образом, в законе, касающемся здравоохранения и благосостояния гражданского населения, есть место, где ОТА может быть применимо, хотя оно действительно. только для исследований и разработок, а не прототипов или производства.
Закон гласит, что секретарь BARDA обладает полномочиями ОТ.
в отношении продукта, который является или может стать квалифицированная контрмера или квалифицированный пандемический или эпидемический продукт, деятельность, которая преимущественно—
(i) проводятся после фундаментальных исследований и доклинической разработки продукта; и
(ii) связаны с производством продукта в коммерческих масштабах и в форме, удовлетворяющей нормативным требованиям Федерального Закон о еде, лекарствах и косметике [ОСК 21 301 и далее] или под статья 262 настоящего титула.
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
«Регуляторные требования», перечисленные в законе, означают, что для BARDA/HHS будет невозможно заключать соглашения – даже просто НИОКР – для любых медицинских продуктов (например, мРНК-вакцин), которые не прошли строгие испытания на безопасность и строгий производственный надзор.
«Партнерство» HHS с Министерством обороны обошло законы о защите гражданского населения
Подводя итог затруднительному положению других транзакционных органов/соглашений в отношении гражданских властей в целом и мРНК-вакцин Covid, в частности:
- ОТА был написан и систематизирован как способ приобретения вооруженными силами вооруженных сил и других необходимых систем и оборудования без особой бюрократической волокиты. Он охватывает исследования и разработки, прототипы и последующее производство.
- Единственным OTA для агентства общественного здравоохранения является HHS, и оно охватывает только исследования и разработки, а не прототипы или производство.
- Даже OTA на исследования и разработки, переданное HHS, по-прежнему требует, чтобы продукция производилась «в форме, которая удовлетворяет нормативным требованиям» по безопасности лекарств и вакцин.
Другими словами: HHS не может использовать свой очень ограниченный OTA для подписания контрактов на сотни миллионов новых медицинских продуктов.
Так что же сделало HHS?
Как отметила Счетная палата правительства (GAO) в своем Отчет за июль 2021 года о «Заговоре Covid-19»: HHS «сотрудничал» с Министерством обороны, чтобы «использовать полномочия Министерства обороны по OTA… которых у HHS не было». (П. 24)
Каковы полномочия Министерства обороны США по ОТ для медицинской продукции?
Как уже говорилось, OTA призван помочь военным получить оборудование и технологии без особых бюрократических хлопот. Ни в одном из первоначальных законов, касающихся ОТА, не упоминалось ничего, кроме «платформ, систем, компонентов или материалов», предназначенных для «повышения эффективности миссии военного персонала».
Но за пять лет до Covid было введено исключительное использование OTA:
В 2015, Министерство обороны объявило создание Консорциума по медицинскому противодействию ХБРЯ, целью которого было использовать путь приобретения OTA для «работы с Министерством обороны над разработкой лицензированных FDA химических, биологических, радиологических и ядерных медицинских средств противодействия». [FDA = Управление по санитарному надзору за качеством пищевых продуктов и медикаментов]
Как описано в объявлении 2015 года, это включало «прототипы технологий для терапевтических медицинских контрмер, нацеленных на вирусные, бактериальные и биологические токсины, представляющие интерес для Министерства обороны». В список агентов вошли основные возбудители биологической войны, такие как сибирская язва, Эбола и Марбург.
Далее в объявлении указывалось, что «технологии, обеспечивающие возможность, могут включать модели животных вирусных, бактериальных или биологических токсинов и их патогенеза (множественные пути воздействия), анализы, диагностические технологии или другие платформенные технологии, которые могут быть применены для разработки утвержденных или лицензированных МКМ. [медицинские контрмеры]».
Хотя это по-прежнему не похоже на производство 100 миллионов новых вакцин для гражданского использования, это действительно предоставляет OTA больше свободы, чем очень ограниченное Управление по другим транзакциям, предоставленное HHS.
В то время как OTA HHS требует соблюдения обширных правил разработки и производства, путь OTA для Министерства обороны по разработке медицинских контрмер требует только «лицензии FDA».
Таким образом, используя другие органы по транзакциям Министерства обороны США, теоретически можно обойти любые правила безопасности – в зависимости от требований FDA по лицензированию продукта, созданного OTA. Как мы увидим, в случае мРНК-вакцин Covid было получено разрешение на экстренное использование, которое вообще не требовало юридического контроля за безопасностью.
Разрешение на использование в чрезвычайных ситуациях (EUA)
Вот как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) описывает свои полномочия EUA:
Статья 564 Закона о FD&C (21 USC 360bbb – 3) позволяет FDA усилить защиту общественного здравоохранения от биологических, химических, ядерных и радиологических агентов.
Благодаря этому полномочию EUA FDA может помочь гарантировать, что медицинские контрмеры могут использоваться в чрезвычайных ситуациях для диагностики, лечения или предотвращения серьезных или опасных для жизни заболеваний или состояний, вызванных биологическими, химическими, ядерными или радиологическими агентами, когда нет адекватных, одобренных и доступные альтернативы (среди других критериев).
Чрезвычайно важно понимать, что эти полномочия EUA были предоставлены в 2004 году при весьма специфических обстоятельствах, связанных с готовностью к атакам с применением оружия массового уничтожения, также известного как ХБРЯ (химические, биологические, радиологические, ядерные) агенты.
Как объяснил в Законе о здоровье Гарвардского университета,
В конечном итоге именно война с террором привела к разрешению использования в чрезвычайных ситуациях. После событий 11 сентября 2001 года и последующих атак с использованием почты сибирской язвы Конгресс принял закон Закон о проекте «Биощит» 2004 г.. Закон предусматривал выделение миллиардов долларов на закупку вакцин для подготовки к биотеррористической атаке, а также на накопление запасов экстренных контрмер. Чтобы иметь возможность быстро действовать в чрезвычайной ситуации, Конгресс разрешил FDA разрешить официально неодобренные продукты для экстренного использования против угрозы здоровью и безопасности населения (при условии объявления чрезвычайной ситуации со стороны HHS). запись указывает на то, что Конгресс сосредоточил свое внимание именно на угрозе биотерроризма, а не на подготовке к естественной пандемии.
Ассоциация формулировка закона ЕСА подчеркивает тот факт, что оно предназначалось для использования в ситуациях, связанных с оружием массового поражения. Вот 4 ситуации, в которых можно выдать EUA:
- определение министра внутренней безопасности о наличии чрезвычайной ситуации внутри страны или значительной вероятности возникновения чрезвычайной ситуации внутри страны, связанной с повышенным риском нападения с применением биологического, химического, радиологического или ядерного агента или агентов;
- определение министра обороны о том, что существует военная чрезвычайная ситуация или значительная вероятность возникновения военной чрезвычайной ситуации, предполагающая повышенный риск для Соединенных Штатов. Области вооруженные силы, включая личный состав, действующий в соответствии с Разделом 10 или Разделом 50, нападения с —
- биологический, химический, радиологический или ядерный агент или агенты; или
- агент или агенты, которые могут вызвать или иным образом связаны с неизбежным опасным для жизни и конкретным риском для «Юнайтед» Области военные силы;
- определение со стороны Секретарь что существует чрезвычайная ситуация в области общественного здравоохранения или значительная вероятность возникновения чрезвычайной ситуации в области общественного здравоохранения, которая затрагивает или имеет значительный потенциал повлиять на национальную безопасность или здоровье и безопасность Соединенных Штатов. Области граждане, проживающие за границей, и это связано с биологическим, химическим, радиологическим или ядерным агентом или агентами, или заболеванием или состоянием, которое может быть связано с таким агентом или агентами; или
- выявление материальной угрозы в соответствии с разделом 319F-2 Закон о здравоохранении [42 США 247д–6б] достаточно, чтобы повлиять на национальную безопасность или здоровье и безопасность Соединенных Штатов. Области граждане, проживающие за рубежом.
Нигде в этих четырех ситуациях нет никакого упоминания о естественно возникшей эпидемии, пандемии или любой другой ситуации в области общественного здравоохранения, которая не была бы вызвана «биологическими, химическими, радиологическими или ядерными агентами».
Может ли SARS-CoV-2 считаться таким агентом?
Если вы ищете определение «биологические агентыВ Юридическом кодексе США вы пойдете по следующему пути:
Преступления и уголовный процесс -> Преступления -> Биологическое оружие -> Определения
Таким образом, в контексте законодательства США термин «биологические агенты» означает биологическое оружие, и использование таких агентов/оружия рассматривается как преступление.
Википедия это предоставляет определение:
Биологический агент (также называемый биологическим агентом, агентом биологической угрозы, агентом биологической войны, биологическим оружием или биологическим оружием) бактерия, вирус, простейшее, паразит, грибили токсин, который можно целенаправленно использовать в качестве оружия в биотерроризма or биологическая война (ЧБ).
На каком правовом основании было выдано EUA для мРНК-вакцин Covid?
Судя по законам, касающимся EUA, может показаться, что ни одна из четырех возможных ситуаций, описанных в законе, не может быть применена к продукту, предназначенному для предотвращения или лечения заболевания, вызванного естественным патогеном.
Тем не менее, этот закон был использован для авторизации мРНК-вакцин против Covid.
Учитывая четыре варианта, перечисленных в законе EUA, для «контрмер» Covid был использован тот,
в) определение Секретарь что существует чрезвычайная ситуация в области общественного здравоохранения или значительная вероятность возникновения чрезвычайной ситуации в области общественного здравоохранения, которая затрагивает или имеет значительный потенциал повлиять на национальную безопасность или здоровье и безопасность Соединенных Штатов. Области гражданам, проживающим за границей, и это связано с биологическим, химическим, радиологическим или ядерным агентом или агентами, или заболеванием или состоянием, которое может быть связано с таким агентом или агентами.
После появления применяется специально к Covid, вот как это было сформулировано:
Секретарь Министерства здравоохранения и социальных служб (HHS) определил, что существует чрезвычайная ситуация в области общественного здравоохранения, которая может серьезно повлиять на национальную безопасность или здоровье и безопасность граждан США, живущих за границей, и которая связана с вирусом, вызывающим коронавирус. Болезнь 2019 (COVID-19)…
Здесь нет сомнений в том, что «вирус, вызывающий COVID-19», считается эквивалентом «биологического, химического, радиологического или ядерного агента или агентов».
Также важно отметить, что «определение чрезвычайной ситуации в области общественного здравоохранения» EUA полностью отделено и никоим образом не зависит от любых других деклараций о чрезвычайных ситуациях в области общественного здравоохранения, таких как те, которые были сделаны ВОЗ, правительством США. и президент в начале пандемии Covid-19.
Таким образом, даже когда ВОЗ, правительство США и президент заявляют, что пандемия закончилась, разрешение на экстренное использование все равно может быть получено, если секретарь HHS продолжит утверждать, что ситуация, описанная в разделе C), существует.
Глядя на все EUA для сотен медицинских продуктов, связанных с Covid, очень трудно понять, как министр здравоохранения мог бы оправдать утверждение о том, что «существует чрезвычайная ситуация в области общественного здравоохранения, которая имеет значительный потенциал повлиять на национальную безопасность или здоровье и безопасность граждан США, живущих за рубежом» в большинстве, если не во всех, этих случаев.
Дополнительные «законодательные критерии» для FDA для выдачи разрешения на экстренное использование
Как только секретарь HHS объявляет, что существует чрезвычайная ситуация в области общественного здравоохранения, требующая EUA, на основании одной из четырех ситуаций, перечисленных в законе, возникают еще четыре «законодательных критерия», которые должны быть соблюдены, чтобы FDA выдало EUA. . Вот как FDA объясняет эти требования:
- Серьезное или опасное для жизни заболевание или состояние
Чтобы FDA выдало EUA, агент(ы) ХБРЯ, упомянутые в декларации EUA секретаря HHS, должны быть способны вызывать серьезное или опасное для жизни заболевание или состояние.
ПРИМЕЧАНИЕ. Этот критерий повторяет спецификацию агента ХБРЯ, который юридически определяется как оружие, используемое при совершении преступления.
- Доказательства эффективности
Медицинские продукты, которые могут рассматриваться для получения EUA, — это те, которые «могут быть эффективными» для предотвращения, диагностики или лечения серьезных или опасных для жизни заболеваний или состояний, которые могут быть вызваны агентом(ами) ХБРЯ, указанным в заявлении секретаря HHS о чрезвычайная ситуация или угроза чрезвычайной ситуации в соответствии с разделом 564 (b).
Стандарт «может быть эффективным» для EUA предусматривает более низкий уровень доказательности, чем стандарт «эффективности», который FDA использует для одобрения продуктов. FDA намеревается оценить потенциальную эффективность возможного продукта EUA в каждом конкретном случае, используя анализ риска и выгоды, как описано ниже.
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
ЮРИДИЧЕСКИЙ ВОПРОС: Как кто-либо может на законных основаниях утверждать, что продукт, разрешенный в соответствии с EUA, является «безопасным и эффективным», если правовой стандарт EUA «может быть эффективным», а FDA заявляет, что это «более низкий уровень доказательности», чем используемый стандарт? для регулярных утверждений продукции?
- Анализ рисков и выгод
Продукт может быть рассмотрен для включения в EUA, если комиссар определит, что известные и потенциальные преимущества продукта при его использовании для диагностики, предотвращения или лечения выявленного заболевания или состояния перевешивают известные и потенциальные риски продукта.
При определении того, перевешивают ли известные и потенциальные преимущества продукта известные и потенциальные риски, FDA намерен посмотреть на совокупности научных данных, чтобы сделать общее определение соотношения риска и пользы. Такие доказательства, которые может возникнуть из различных источников, может включать (но не ограничивается): результаты отечественных и зарубежных клинических исследований, данные об эффективности in vivo на животных моделях и данные in vitro, доступен для рассмотрения FDA. FDA также оценит качество и количество препарата. доступные доказательства, учитывая современное состояние научных знаний.
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
ЮРИДИЧЕСКОЕ ПРИМЕЧАНИЕ. Не существует юридического стандарта и юридических определений того, что означает, что «известные и потенциальные выгоды» перевешивают «известные и потенциальные риски». Также не существует качественного или количественного юридического определения того, что представляет собой приемлемые «доступные доказательства», на которых «может» основываться анализ рисков и выгод. Фактических доказательств может быть нуль, но есть вера в то, что продукт имеет много потенциальных преимуществ и не так много потенциального риска, и это удовлетворяет этому «законодательному требованию».
- Нет альтернатив
Чтобы FDA выдало EUA, не должно быть адекватной, одобренной и доступной альтернативы потенциальному продукту для диагностики, профилактики или лечения заболевания или состояния. Потенциальный альтернативный продукт может считаться «недоступным», если запасы одобренной альтернативы недостаточны для полного удовлетворения экстренных потребностей.
ЮРИДИЧЕСКИЙ ВОПРОС: Помимо вопиющего и потенциально преступного очернения/объявления вне закона альтернативных методов лечения Covid-19, таких как ивермектин и гидроксихлорохин, в какой момент существовала одобренная альтернатива для «предотвращения Covid-19» (единственное, для чего были закуплены мРНК-вакцины) ) – Например, Паксловид – что сделает EUA для мРНК-вакцин больше незаконным?
Вот как все эти «законодательные критерии» были соблюдены на практике. Разрешение на экстренное использование мРНК-вакцин BioNTEch/Pfizer Covid:
Я пришел к выводу, что экстренное использование вакцины Pfizer-BioNTech против COVID-19 для профилактики COVID-19 при ее введении, как описано в области разрешения (раздел II), соответствует критериям выдачи разрешения в соответствии с разделом 564(c) Закона, потому что:
- SARS-CoV-2 может вызвать серьезное или опасное для жизни заболевание или состояние, включая тяжелые респираторные заболевания, у людей, инфицированных этим вирусом;
- На основании совокупности научных данных, доступных FDA, можно предположить, что вакцина Pfizer-BioNTech против COVID-19 может оказаться эффективным средством профилактики COVID-19и что при использовании в условиях, описанных в настоящем разрешении, известные и потенциальные преимущества вакцины Pfizer-BioNTech против COVID-19 при использовании для предотвращения COVID-19 перевесить известные и потенциальные риски; и
- Не существует адекватной, одобренной и доступной альтернативы экстренному использованию вакцины Pfizer-BioNTech против COVID-19. для предотвращения COVID-19.
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
ПРИМЕЧАНИЕ. Единственным контекстом, в котором FDA взвешивало потенциальные преимущества и риски вакцины и в котором FDA определило, что она «может быть эффективной», был в предотвращении Covid-19.
Не принимается во внимание, нет доказательств фактической или потенциальной пользы, а также нет определения того, что существует какая-либо потенциальная эффективность вакцины для чего-либо еще, включая: снижение риска тяжелого заболевания, снижение риска госпитализации, снижение риска смерти. , снижая риск возникновения любых состояний, фактически или потенциально связанных с Covid-19.
ПОЭТОМУ можно было бы разумно усомниться в законности любых утверждений о том, что вакцина «безопасна и эффективна» в контексте чего-либо иного, кроме «при использовании для предотвращения COVID-19» – чего, как было известно, вакцины НЕ ДЕЛАЛИ вскоре после того, как они были представил.
Если бы людям сказали, что мРНК-вакцины BioNTech/Pfizer «безопасны и эффективны» в чем-либо, кроме профилактики Covid-19, и если бы им угрожали какие-либо последствия за отказ принять вакцину для чего-либо, кроме профилактики Covid-19, могли бы они есть законные аргументы в пользу того, что их незаконно вынудили принять неутвержденный продукт под мошенническими заявлениями?
Требования третьего уровня EUA для неутвержденных продуктов
Как только у нас будет экстренная декларация, специфичная для EUA, и как только FDA заявит, что продукт может быть эффективным и что любые доступные доказательства (от нуля до бесконечности) показывают, что его преимущества перевешивают его риски (определяемые тем, что, по мнению FDA, они могут быть), существует еще один уровень регулирования, не связанного с безопасностью и эффективностью.
Вот как Отчет Исследовательской службы Конгресса США о EUA за 2018 г. объясняет это:
§564 FFDCA предписывает FDA налагать определенные обязательные условия в EUA и допускает дополнительные дискреционные условия, где это необходимо. Требуемые условия различаются в зависимости от того, предназначено ли EUA для неутвержденного продукта или для несанкционированного использования утвержденного продукта. Для неутвержденного продукта условия использования должны:
(1) обеспечить получение необходимой информации медицинскими работниками, применяющими препарат;
(2) гарантировать, что лица, которым применяется продукт, получают необходимую информацию;
(3) обеспечивать мониторинг и отчетность о нежелательных явлениях, связанных с продуктом; и
(4) обеспечивать ведение учета и отчетности производителя.
ЮРИДИЧЕСКИЙ ВОПРОС: Что именно представляет собой «необходимая информация?» Мы знаем, что люди были проинформированы о том, что вакцинам было дано разрешение на экстренное использование. Но сказали ли им, что это означает «более низкий уровень доказательств», чем требуется для заявлений о «безопасности и эффективности» других медицинских продуктов? Были ли они проинформированы о том, что существуют разные уровни «безопасности и эффективности» в зависимости от того, имеет ли продукт разрешение EUA или другой тип разрешения?
ПРИМЕЧАНИЕ. Закон требует, чтобы существовал способ отслеживать нежелательные явления и сообщать о них. Однако в нем не указано, кто осуществляет мониторинг, каковы стандарты отчетности и каков порог принятия мер на основе отчетов.
EUA по сравнению с любым другим способом утверждения лекарств/вакцин
Как исследователь/писатель Саша Латыпова Как отметил, многих людей смутило EUA, потому что оно очень похоже на EAU, что означает «использование расширенного доступа». Это тип разрешения, выдаваемого медицинским продуктам в случае острой необходимости со стороны определенной группы пациентов (например, больных раком IV стадии, ожидаемая продолжительность жизни которых измеряется месяцами), которые готовы рисковать нежелательными явлениями и даже смертью в обмен на доступ. на экспериментальное лечение.
Разрешение на экстренное использование никоим образом не связано и не имеет никакого сходства с использованием расширенного доступа.
Различные правовые пути авторизации медицинской продукции аккуратно представлены в таблице, представленной исследователем-юристом. Кэтрин Уотт. Таблица является частью презентации 2020 года для совместной учебной сессии FDA-CDC: Нормативные обновления по использованию медицинских контрмер.
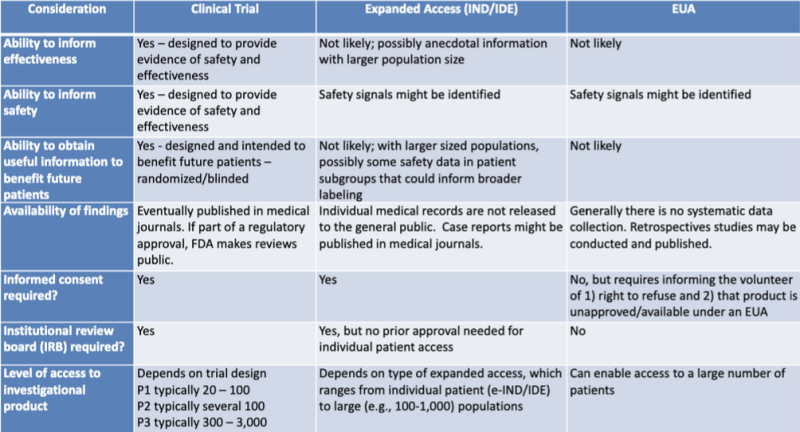
Эта таблица очень четко показывает, что процесс EUA вряд ли предоставит информацию об эффективности продукта, не предназначен для предоставления доказательств безопасности, вряд ли предоставит полезную информацию для пользы будущим пациентам, не предполагает систематического сбора данных, не требует ретроспективных исследований. нет информированного согласия и нет институционального наблюдательного совета.
Более того, в 2009 г. Медицинский институт Национального академического издания., также выделенный Уоттом и озаглавленный «Медицинские контрмеры: выдача разрешения на экстренное использование и почтовая модель – Краткое содержание семинара», мы находим это утверждение на стр. 28:
Важно признать, что EUA не является частью пути развития; это совершенно отдельный объект, который используется только в чрезвычайных ситуациях и не является частью процесса утверждения препарата.
Означает ли это, что одобрение мер противодействия Covid-19, основанных на EUA, было незаконным? Означает ли это, что не существует законного способа заявить, что продукт EUA «безопасен и эффективен», поскольку он НЕ ЯВЛЯЕТСЯ ЧАСТЬЮ ПРОЦЕССА УТВЕРЖДЕНИЯ ЛЕКАРСТВА?
Заключение
Это совершенно очевидно, учитывая всю информацию, содержащуюся в этой статье и в предыдущей статье. Часть 1, что мРНК-вакцины BioNTach/Pfizer Covid были разработаны, произведены и разрешены в соответствии с военными законами, предназначенными для чрезвычайных ситуаций, связанных с биологическим оружием/терроризмом, а не естественными заболеваниями, поражающими все гражданское население.
Таким образом, соблюдение правил и надзора, которые мы ожидаем обнаружить, когда продукт считается «безопасным и эффективным» для всего гражданского населения, не требовалось по закону.
Можно ли использовать этот анализ для того, чтобы оспорить законность заявления о «безопасности и эффективности» тех правительственных чиновников, которые знали, что влечет за собой EUA? Есть ли другие юридические последствия?
Я надеюсь на это.
Важно отметить, что в судебных исках против мРНК-вакцин Covid, поданных до сих пор, не было никаких постановлений (насколько мне известно) о том, может ли военное право, такое как OTA и EUA, применяться к гражданским ситуациям. Однако в своем заявлении судья окружного суда Майкл Трункале сделал заявление. прекращение дела осведомителя Брук Джексон против Ventavia и Pfizer, это важно иметь в виду.
Здесь судья признает, что соглашение о мРНК-вакцинах BioNTech/Pfizer было военным OTA, но он отказывается выносить решение о его применимости к невоенным обстоятельствам (естественное заболевание, 100 миллионов доз, в основном не для военного использования), при которых оно было выпущено:
Тот факт, что вакцину получили как военнослужащие, так и гражданские лица, не означает, что приобретение вакцины не имело никакого значения для повышения эффективности миссии военных. Что еще более важно, г-жа Джексон фактически просит этот суд отменить решение Министерства обороны о применении других полномочий по транзакциям для приобретения вакцины Pfizer. Но, как уже давно подчеркнул Верховный суд США, «сложные, тонкие и профессиональные решения относительно состава, подготовки, оснащения и управления вооруженными силами являются, по сути, профессиональными военными решениями». Гиллиган против Моргана, 413 США 1, 10 (1973). Таким образом, «трудно представить себе область государственной деятельности, в которой суды имели бы меньшую компетенцию». Идентификатор. Этот суд не будет накладывать вето на решения Министерства обороны относительно эффективности миссии во время чрезвычайного положения в стране.
Это лишь одно из многих юридических препятствий, которые остаются в борьбе за то, чтобы в конечном итоге объявить вне закона все продукты мРНК, одобренные во время чрезвычайной ситуации с Covid-19, а также любые последующие продукты мРНК, одобрение которых было основано на процессе утверждения Covid-19.
Опубликовано под Creative Commons Attribution 4.0 Международная лицензия
Для перепечатки установите каноническую ссылку на оригинал. Институт Браунстоуна Статья и Автор.









