Во время пандемии Covid правительство США потратило миллиарды долларов на почти 400 продуктов, предназначенных для защиты, диагностики и лечения сотен миллионов людей – все с маркировкой «EUA» или «Разрешение на экстренное использование».
Но что на самом деле означает EUA?
Прежде чем мы ответим на этот вопрос и чтобы понять, какое место занимает EUA по отношению к другим путям авторизации или одобрения медицинской продукции, полезно взглянуть на чем не является EUA:
EUA не является обозначением экспериментального продукта, проходящего клинические испытания.
Если мы понимаем только одно о EUA, то это должно быть так: EUA не применяется к продукту, проходящему клинические испытания, регулируемые правилами FDA или другими законодательными требованиями.
EUA также не то же самое, что расширенный доступ к использованию (EAU), часто называемый доступом «сострадательного использования», который применяется к предоставлению пациентам с тяжелыми, неизлечимыми заболеваниями доступа к экспериментальным продуктам до того, как они будут полностью одобрены.
Эта таблица из Презентация FDA-CDC 2020 обобщает различия между продуктами, проходящим клинические испытания, продуктами, предоставляемыми пациентам посредством расширенного «сострадательного» доступа, и продуктами, разрешенными через EUA:
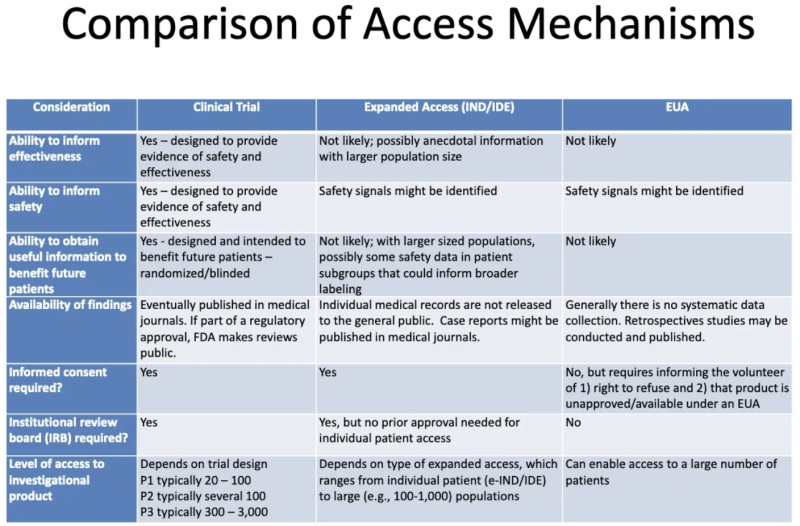
Вот что эта таблица говорит нам о EUA:
- Процесс предоставления EUA вряд ли даст какую-либо информацию об эффективности продукта.
- Процесс предоставления EUA не предназначен для предоставления доказательств безопасности или эффективности, но сигналы безопасности могут быть идентифицированы.
- Маловероятно, что после того, как продукт получит разрешение EUA и будет введен некоторым пациентам, будет получена какая-либо полезная информация, которая принесет пользу каким-либо будущим пациентам.
- Систематического сбора данных об эффективности и безопасности EUA не ведется, и никакие данные не публикуются в медицинских журналах в рамках процесса одобрения регулирующих органов.
- Никакого информированного согласия не требуется, но пациентам, которые «добровольно» принимают продукт, необходимо сообщить, что они могут отказаться и что продукт не одобрен/не доступен согласно EUA.
- Институциональный наблюдательный совет (IRB) не требуется. [IRB это совет, который должен защищать благополучие людей, участвующих в клинических испытаниях]
Чтобы еще больше прояснить, насколько EUA отличается от любого обычного процесса утверждения, в 2009 г., публикация Института медицины Национальных академий., мы находим это утверждение:
Важно признать, что EUA не является частью пути развития; это совершенно отдельный объект, который используется только в чрезвычайных ситуациях и не является частью процесса утверждения препарата. (стр. 28)
Подведем итоги:
Процесс предоставления продукта EUA вряд ли приведет к каким-либо доказательствам безопасности или эффективности. После того, как продукт получит разрешение EUA и будет введен пациентам, маловероятно, что будет получена какая-либо полезная информация, которая принесет пользу будущим пациентам, поскольку не ведется систематический сбор данных об эффективности и безопасности.
Основываясь на всей этой очень четкой информации от CDC/FDA и IMNA, было бы справедливо заключить, что разрешение на экстренное использование — это процесс, который следует применять очень разумно и только в случаях крайней необходимости.
Теперь давайте посмотрим, на какие виды чрезвычайных ситуаций по закону рассчитано EUA.
EAU предназначен для чрезвычайных ситуаций, связанных с применением оружия массового уничтожения
Законы, разрешающие использование «Механизма доступа» EUA, описанного выше, были разработаны для случаев чрезвычайных, немедленных чрезвычайных ситуаций, связанных с оружием массового уничтожения (ОМУ), также называемым ХБРЯ (химическими, биологическими, радиологическими, ядерными) агентами.
Вот как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) описывает свои полномочия EUA:
Статья 564 Закона о FD&C (21 USC 360bbb – 3) позволяет FDA усилить защиту общественного здравоохранения от биологических, химических, ядерных и радиологических агентов.
Благодаря этому полномочию EUA FDA может помочь гарантировать, что медицинские контрмеры могут использоваться в чрезвычайных ситуациях для диагностики, лечения или предотвращения серьезных или опасных для жизни заболеваний или состояний, вызванных биологическими, химическими, ядерными или радиологическими агентами, когда нет адекватных, одобренных и доступные альтернативы (среди других критериев).
Эти полномочия EUA были предоставлены в 2004 году при весьма специфических обстоятельствах, связанных с готовностью к атакам агентов ХБРЯ.
Как объяснил в Законе о здоровье Гарвардского университета,
В конечном итоге именно война с террором привела к разрешению использования в чрезвычайных ситуациях. После событий 11 сентября 2001 года и последующих атак с использованием почты сибирской язвы Конгресс принял закон Закон о проекте «Биощит» 2004 г..
Ассоциация запись указывает на то, что Конгресс сосредоточил свое внимание именно на угрозе биотерроризма, а не на подготовке к естественной пандемии.
Учитывая такой узкий тип действительно экстремальной чрезвычайной ситуации, связанной с атакой с использованием оружия массового уничтожения, понятно, почему «механизм доступа» EUA не требует тщательного надзора со стороны регулирующих органов или соблюдения каких-либо стандартов производства или клинических испытаний.
Так чего же на самом деле требует механизм доступа EUA?
3 шага для получения разрешения на экстренное использование (EUA)
Для того чтобы медицинское изделие получило разрешение EUA, должны произойти три вещи:
- Министр внутренней безопасности, министр обороны или министр здравоохранения и социальных служб должны определить, что существует чрезвычайная ситуация, связанная с нападением или угрозой нападения с использованием агента ХБРЯ или заболевания, вызванного таким агентом.
- При выдаче EUA FDA должно убедиться, что оно соответствует четырем «законодательным критериям».
- FDA должно «ввести определенные необходимые условия» в EUA.
Шаг 1 EUA: Объявление чрезвычайной ситуации, связанной с ХБРЯ
Чрезвычайная декларация для EUA является отдельной и не связана с какими-либо другими чрезвычайными декларациями, которые могут быть изданы президентом, секретарем HHS или кем-либо еще. Оно должно быть выдано специально с целью активации EUA и может быть прекращено или продлено независимо от любого другого чрезвычайного объявления.
Вот что закон EUA гласит Вот четыре возможных сценария активации «механизма доступа» EUA:
- определение министра внутренней безопасности о наличии чрезвычайной ситуации внутри страны или значительной вероятности возникновения чрезвычайной ситуации внутри страны, связанной с повышенным риском нападения с применением биологического, химического, радиологического или ядерного агента или агентов;
- определение министра обороны о том, что существует военная чрезвычайная ситуация или значительная вероятность возникновения военной чрезвычайной ситуации, предполагающая повышенный риск для Объединенный Области вооруженные силы, включая личный состав, действующий в соответствии с Разделом 10 или Разделом 50, нападения с —
- биологический, химический, радиологический или ядерный агент или агенты; или
- агент или агенты, которые могут вызвать или иным образом связаны с неизбежным опасным для жизни и конкретным риском для «Юнайтед» Области военные силы;
- определение со стороны Секретарь [Здравоохранения и социальных служб], что существует чрезвычайная ситуация в области общественного здравоохранения или значительная вероятность возникновения чрезвычайной ситуации в области общественного здравоохранения, которая затрагивает или имеет значительный потенциал повлиять на национальную безопасность или здоровье и безопасность Объединенный Области граждане, проживающие за границей, и это связано с биологическим, химическим, радиологическим или ядерным агентом или агентами, или заболеванием или состоянием, которое может быть связано с таким агентом или агентами; или
- выявление материальной угрозы в соответствии с разделом 319F-2 Закон о здравоохранении [42 США 247д–6б] достаточно, чтобы повлиять на национальную безопасность или здоровье и безопасность Объединенный Области граждане, проживающие за рубежом.
Шаг 2 EUA. Соответствие законодательным критериям
Как только один из секретарей заявил, что существует чрезвычайная ситуация, требующая EUA, есть еще четыре «законодательных критерия», которые должны быть выполнены, чтобы FDA выдало EUA. Вот как FDA объясняет эти требования:
- Серьезное или опасное для жизни заболевание или состояние
Чтобы FDA выдало EUA, агент(ы) ХБРЯ, упомянутые в декларации EUA секретаря HHS, должны быть способны вызвать серьезное или опасное для жизни заболевание или состояние.
- Доказательства эффективности
Медицинские продукты, которые могут рассматриваться для получения EUA, — это те, которые «могут быть эффективными» для предотвращения, диагностики или лечения серьезных или опасных для жизни заболеваний или состояний, которые могут быть вызваны агентом(ами) ХБРЯ, указанным в заявлении секретаря HHS о чрезвычайная ситуация или угроза чрезвычайной ситуации в соответствии с разделом 564 (b).
Стандарт «может быть эффективным» для EUA предусматривает более низкий уровень доказательности, чем стандарт «эффективности», который FDA использует для одобрения продуктов. FDA намеревается оценить потенциальную эффективность возможного продукта EUA в каждом конкретном случае, используя анализ риска и выгоды, как описано ниже.
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
- Анализ рисков и выгод
Продукт может быть рассмотрен для включения в EUA, если комиссар определит, что известные и потенциальные преимущества продукта при его использовании для диагностики, предотвращения или лечения выявленного заболевания или состояния перевешивают известные и потенциальные риски продукта.
При определении того, перевешивают ли известные и потенциальные преимущества продукта известные и потенциальные риски, FDA намерен посмотреть на совокупности научных данных, чтобы сделать общее определение соотношения риска и пользы. Такие доказательства, которые может возникнуть из различных источников, может включать (но не ограничивается): результаты отечественных и зарубежных клинических исследований, данные об эффективности in vivo на животных моделях и данные in vitro, доступен для рассмотрения FDA. FDA также оценит качество и количество препарата. доступные доказательства, учитывая современное состояние научных знаний.
[ЖИРНЫЙ ФИКС ДОБАВЛЕН]
- Нет альтернатив
Чтобы FDA выдало EUA, не должно быть адекватной, одобренной и доступной альтернативы потенциальному продукту для диагностики, профилактики или лечения заболевания или состояния. Потенциальный альтернативный продукт может считаться «недоступным», если запасы одобренной альтернативы недостаточны для полного удовлетворения экстренных потребностей.
EUA Шаг 3. Навязывание необходимых условий
Как только у нас будет экстренная декларация, специфичная для EUA, и как только FDA определит, что продукт может быть эффективным и что все доступные доказательства показывают, что его преимущества перевешивают его риски, появится еще один уровень соответствующего регулирования.
Вот как Отчет Исследовательской службы Конгресса США о EUA за 2018 г. объясняет это:
§564 FFDCA предписывает FDA налагать определенные обязательные условия в EUA и допускает дополнительные дискреционные условия, где это необходимо. Требуемые условия различаются в зависимости от того, предназначено ли EUA для неутвержденного продукта или для несанкционированного использования утвержденного продукта. Для неутвержденного продукта условия использования должны:
(1) обеспечить получение необходимой информации медицинскими работниками, применяющими препарат;
(2) гарантировать, что лица, которым применяется продукт, получают необходимую информацию;
(3) обеспечивать мониторинг и отчетность о нежелательных явлениях, связанных с продуктом; и
(4) обеспечивать ведение учета и отчетности производителя.
Заключение
Как отмечается в этой статье, FDA/CDC четко осознают, что процесс выдачи разрешения на экстренное использование (EUA) вряд ли приведет к получению какой-либо информации об эффективности или безопасности продукта. Когда мы смотрим на букву закона, регулирующего EUA, мы видим, что это действительно правильная оценка.
Закон EUA не устанавливает никаких правовых или нормативных стандартов, которые могли бы определить, является ли продукт безопасным или эффективным. Единственные стандарты заключаются в том, считает ли FDA, что продукт может быть эффективным и что его известные преимущества перевешивают известный вред. Если нет известных вредов или известных преимуществ, поскольку продукт никогда не проходил процедуру одобрения препарата, FDA может использовать любую информацию или стандарты, которые оно выберет, для принятия такого решения.
Из всего этого следует, что компания, чей продукт является кандидатом на получение EUA, может попытаться продемонстрировать безопасность и/или эффективность продукта любыми способами по своему выбору. Наличие такой попытки (будь то клиническое исследование или другой механизм сбора данных) и способ ее проведения зависят от компании. Ничто в законе EUA не применимо к тому, как компания разрабатывает, проводит или анализирует любые исследования или другие механизмы сбора данных, которые она решает использовать.
Применительно к продуктам Covid это означает:
- Для того чтобы продукты Covid получили EUA, не требовалось никаких данных о безопасности или эффективности клинических испытаний.
- Любые клинические испытания, упомянутые в процессе EUA, проводились без каких-либо законодательно применимых нормативных стандартов.
- Когда мы обнаруживаем, что этим продуктам не хватает эффективности и безопасности, это неудивительно. Это весьма вероятный результат процесса.
- Нет данных процесса EUA, на которых можно было бы основывать решения, не относящиеся к EUA, о безопасности или эффективности продукта. Таким образом, любое использование продукта за пределами EUA потребует с самого начала прохождения процедуры юридического одобрения для обычных медицинских продуктов.
Подробнее о процессе одобрения вакцин против Covid здесь.
Переиздано с сайта автора Substack
Опубликовано под Creative Commons Attribution 4.0 Международная лицензия
Для перепечатки установите каноническую ссылку на оригинал. Институт Браунстоуна Статья и Автор.









