The Telegraph недавно сообщалось, что общественности было приказано прекратить принимать лекарства от кашля и простуды из-за опасений по поводу безопасности препарата фолкодина, опиоидного средства от кашля.
Двадцать распространенных лекарств от кашля и простуды, в том числе капсулы Day and Night Nurse, были срочно изъяты с рынка по распоряжению регуляторов из-за опасений по поводу «очень редкого» риска анафилаксии, опасного для жизни побочного явления.
Объявление об отзыве лекарств класса 2 взято из правительства Великобритании. веб-сайт, показано ниже.

Когда дело доходит до мРНК-вакцины против COVID-19, нормативные двойные стандарты еще никогда не были столь очевидны.
Анафилаксия была определена Европейским агентством по лекарственным средствам как важный риск еще в декабре 2020 года в CHMP (Комитет по лекарственным средствам для человека) EMA. отчет об оценке о вакцине Pfizer-BioNTech COVID-19, как показано ниже.
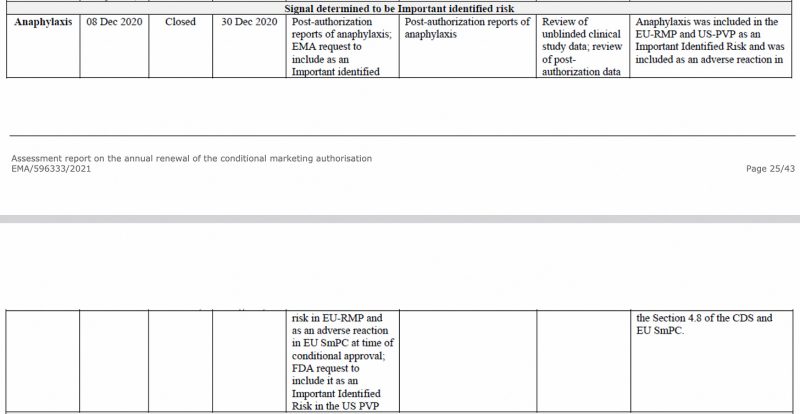
Кроме того, в первом периодическом бюллетене по безопасности в ЕС Report, который я ранее проанализировананафилаксия снова была отмечена как важный выявленный риск.

В этом отчете о фармаконадзоре из пострегистрационных данных было выявлено 3,827 соответствующих случаев (индивидуальных). Страной с самым высоким уровнем заболеваемости стала Япония, за ней следуют США и Великобритания.
Наибольшее число зарегистрированных случаев заболевания было среди женщин: шокирующие 3,182 случая по сравнению с 454 случаями среди мужчин при среднем возрасте 44 года. Тот факт, что среди женщин было зарегистрировано в 7 раз больше случаев, не является чем-то новым. Еще в декабре 2021 г. проанализирован Pfizer подготовил документ для FDA, охватывающий 3-месячный период, с декабря 2020 г. по 28 февраля 2021 г., в случае анафилаксии женщины пострадали в 8 раз чаще.
Таким образом, 98 процентов соответствующих нежелательных явлений (включая анафилактическую реакцию, анафилактический шок, анафилактоидную реакцию и анафилактоидный шок) были классифицированы как серьезные!
Кроме того, в 92 процентах случаев время, прошедшее до возникновения нежелательного явления после введения вакцины, составляло менее 24 часов.

Фатальные исходы
Из 3,922 случаев 28 были смертельными, а исход ошеломляющих 704 случаев был неизвестен. Номера случаев с летальным исходом не приводились.

Случаи по возрастным группам
Из 3,827 соответствующих случаев (индивидуальных) 23 были в детской возрастной группе и 3,021 — во взрослой возрастной группе.
Наличие сопутствующих заболеваний
Примечательно, что примерно 2/3 всех случаев анафилаксии не наличие сопутствующих заболеваний (основных проблем со здоровьем).

Учитывая то, что произошло после того, как были выпущены мРНК-вакцины против COVID-19, неудивительно прочитать: «новой информации по безопасности обнаружено не было в отношении риска анафилаксии с BNT162b2» (вакцина Pfizer-BioNTech COVID-19). Приведенная причина (или оправдание, за которым они прячутся) заключается в том, что «об этом риске сообщают... что включает в себя информацию о соответствующих действиях, которые необходимо предпринять, а именно: «Как и в случае со всеми инъекционными вакцинами, надлежащее медицинское лечение и наблюдение должны быть всегда доступны. в случае редкого анафилактического события после введения вакцины».
Под Правило 174, Информация для медицинских работников Великобритании, который последний раз пересматривался в декабре 2021 года, говорится следующее:

на самом деле, на самом первый день развертывания вакцины Pfizer-BioNTech против COVID-19 в Великобритании было зарегистрировано два сообщения об анафилаксии и один случай возможной аллергической реакции. Это не помешало MHRA отозвать продукт — они просто обошли этот вопрос, заявив, что людям, страдающим аллергией, не следует принимать вакцину.
Даже когда они знали, ингредиенты липидных наночастиц ALC-0159 и ALC-0315 от Pfizer/BioNTech никогда раньше не включались ни в один лицензированный препарат. ALC-0159 содержит ПЭГ (полиэтиленгликоль), который Известно, что он вызывает анафилаксию.
Это однозначно: анафилаксия была известным опасным для жизни побочным явлением примерно в то же время, когда было выдано разрешение на экстренное использование вакцины Pfizer-BioNTech против COVID-19. Тем не менее, поскольку это «инъекционная вакцина», она каким-то образом получила свободный доступ от всех регуляторов лекарственных средств, независимо от того, сколько разоблачающих данных накапливается, когда, с другой стороны, сироп от кашля или капсула срочно отзываются на основании « очень редкий риск анафилаксии».
Переиздано с сайта автора Substack
Опубликовано под Creative Commons Attribution 4.0 Международная лицензия
Для перепечатки установите каноническую ссылку на оригинал. Институт Браунстоуна Статья и Автор.









